‘늘어났다 줄었다’ 맞춤형 치료 상용화 성큼
나노코일의 생체내 원격제어 제어 시스템 개발
나노미터 수준 동적 제어로 맞춤형 임플란트 소재로의 발전 기대
표지논문으로 선정, 과기부 우수성과로도 선정돼

▲ 왼쪽부터 강희민 교수(교신저자), 김영근 교수(교신저자), 민선홍 석박사통합과정생(제1저자), 고민준 석박사통합과정생(제1저자)
공과대학 신소재공학부 연구팀이 임플란트 소재 표면에서 실시간 원격으로 세포의 부착과 분화를 조절할 수 있는 생체내 나노코일 시스템을 개발했다.
이번 연구는 국제학술지 Advanced Materials(Impact Factor: 27.398)에 제1저자 민선홍 석박사통합과정생, 제1저자 고민준 석박사통합과정생, 교신저자 김영근 교수, 교신저자 강희민 교수 순으로 2월 3일(한국시간 기준) 게재됐다.
* 논문명: Remote Control of Time-Regulated Stretching of Ligand-Presenting Nanocoils In Situ Regulates the Cyclic Adhesion and DIfferentiation of Stem Cells
* 저자정보 : 강희민 교수 (교신저자/고려대학교), 김영근 교수(교신저자/고려대학교) 민선홍 (공동 제1저자, 고려대학교), 고민준 (공동 제1저자, 고려대학교), 정희준 박사 (공동 제1저자, Northwestern University), 김원식 (공동저자, 한국과학기술원), 한성범 (공동저자, 고려대학교), 김유리 (공동저자, 고려대학교), 배건휴 (공동저자, 고려대학교), 이성규 (공동저자, 고려대학교), 라마 땅감 (Ramar Thangam) (공동저자, 고려대학교), 최효준 (공동저자, 고려대학교), 나 리 (Na Li) (공동저자, 고려대학교), 신정은 (공동저자, 고려대학교), 전유상 (공동저자, 고려대학교), 박현수 (공동저자, 고려대학교), 김유진 (공동저자, 고려대학교), 우데이 쿠마 스쿠마르 (Uday Kumar Sukumar) (공동저자, Stanford University), 송재준 (공동저자, 고려대학교), 박승근 (공동저자, 공주대학교), 유승호 (공동저자, 고려대학교), 강윤찬 (공동저자, 고려대학교), 이기범 (공동저자, Rutgers University), 퀴앙 웨이 (Qiang Wei) (공동저자, Sichuan University), 김동휘 (공동저자, 고려대학교), 한승민 (공동저자, 한국과학기술원), 라마사미 폴무루간 (Ramasamy Paulmurugan) (공동저자, Stanford University)
줄기세포는 주변 환경을 감지하며 그 환경에 맞는 조직 세포로 분화할 수 있다. 이런 특성을 이용하여 뼈, 지방, 근육, 심근, 혈관, 연골 등 다양한 기관 조직 세포로 분화를 유도할 수 있어 재생 의학 및 공학 분야에서 주목받고 있다. 그러나 체내에서 줄기세포의 부착에 대한 조절뿐만 아니라 분화에 대한 조절이 원활하지 않다는 문제점이 있다.
* 줄기세포 : 상대적으로 미분화된 세포로 주변 환경에 따라 특정 세포로의 분화가 가능하기 때문에, 생체 재생, 인공 장기 형성, 세포 치료 등 환자 맞춤형 치료를 위한 핵심 세포로 각광받고 있음
연구팀은 전기도금을 이용하여 제작된 코발트-철 자성 나노코일을 활용하여 임플란트 소재 표면 위에서 외부 자기장으로 세포 부착성 RGD 리간드의 간격을 가역적으로 실시간 원격 조절할 수 있는 나노코일 시스템을 이용한 줄기세포의 부착 및 분화의 조절이 가능한 시스템을 개발했다.
* 코발트-철 자성 나노코일: 약 70 nm 두께의 나노선이 외경 180 nm, 총 길이 1 μm로 꼬인 나선형 구조로, 자기장을 걸면 신장하고, 자기장이 없으면 원래 길이로 수축하는 가역적인 특성을 갖는 나노구조
* RGD 리간드: 세포 부착을 매개하게 하는 세포외 기질(Extracellular Matrix)의 단백질 중 파이브로넥틴의 아미노산 서열. 세포막에 존재하는 수용체 인테그린(integrin)은 RGD 리간드를 인지하고 세포가 부착되도록 함
나노코일은 생체 내외에서 자기장을 이용하여 실시간 원격으로 RGD 리간드의 간격을 나노미터 수준으로 정밀하게 조절할 수 있도록 유도됐으며, 자기장에 의해 나노코일이 신장하여 RGD 리간드가 넓은 간격으로 제시될 때 줄기세포의 부착율과 골세포로의 분화율이 성공적으로 향상되는 것을 확인할 수 있었다.
환자의 상황에 맞추어 치료 시점을 원격으로 제어할 수 있는 나노코일 시스템의 개발로 임플란트 소재의 생체내 줄기세포의 정밀 제어 가능성을 검증한 데 의의가 있으며, 맞춤형 줄기세포 치료의 상용화 가능성을 제시했다.
이번 연구는 과학기술정보통신부·한국연구재단이 추진하는 신진 연구자지원사업 및 중견연구자지원사업의 지원으로 수행됐으며 최근 과학기술정보통신부 우수성과로도 선정되는 쾌거를 거뒀다.
< 그 림 설 명 >
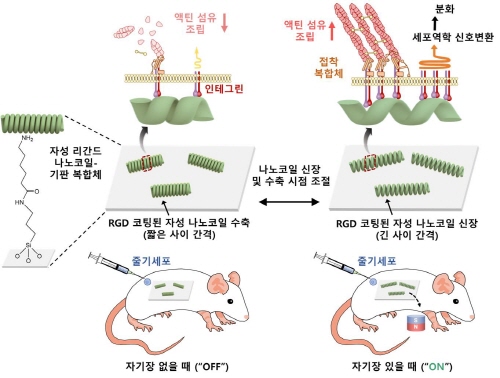
(그림1) 생체내 나노코일 제어 시스템의 모식도
나노코일을 이용하여 임플란트 소재 표면 위에서 리간드의 간격을 자기장으로 정밀하게 제어할 수 있는 나노크기의 신장/수축을 통한 줄기세포의 부착 및 분화의 조절이 가능한 시스템의 모식도.
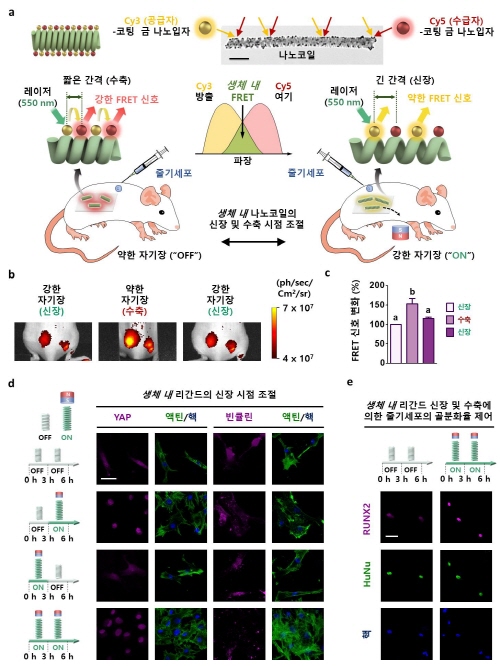
(그림2) 생체내 리간드 간격에 따른 줄기세포 제어 시스템의 모식도
나노코일은 외부 자기장을 이용하여 실시간 원격으로 리간드의 간격을 조절할 수 있도록 유도되었고, 자기장에 의해 나노코일이 신장하여 리간드가 넓은 간격으로 제시될 때 줄기세포의 부착율과 골세포로의 분화율이 성공적으로 향상되는 모식도
커뮤니케이션팀 서민경(smk920@korea.ac.kr)
링크
http://www.korea.ac.kr/user/boardList.do?boardId=474633&siteId=university&page=1&search=&column=&boardType=02&listType=&id=university_060108000000&parent=&boardSeq=489648&command=albumView&chkBoxSeq=&chkBoxId=&chkBoxPos=&chkBoxDepth=&chkBoxFamSeq=&warningYn=N&categoryId=&categoryDepth=&totalYn=&searchDate1=&searchDate2=